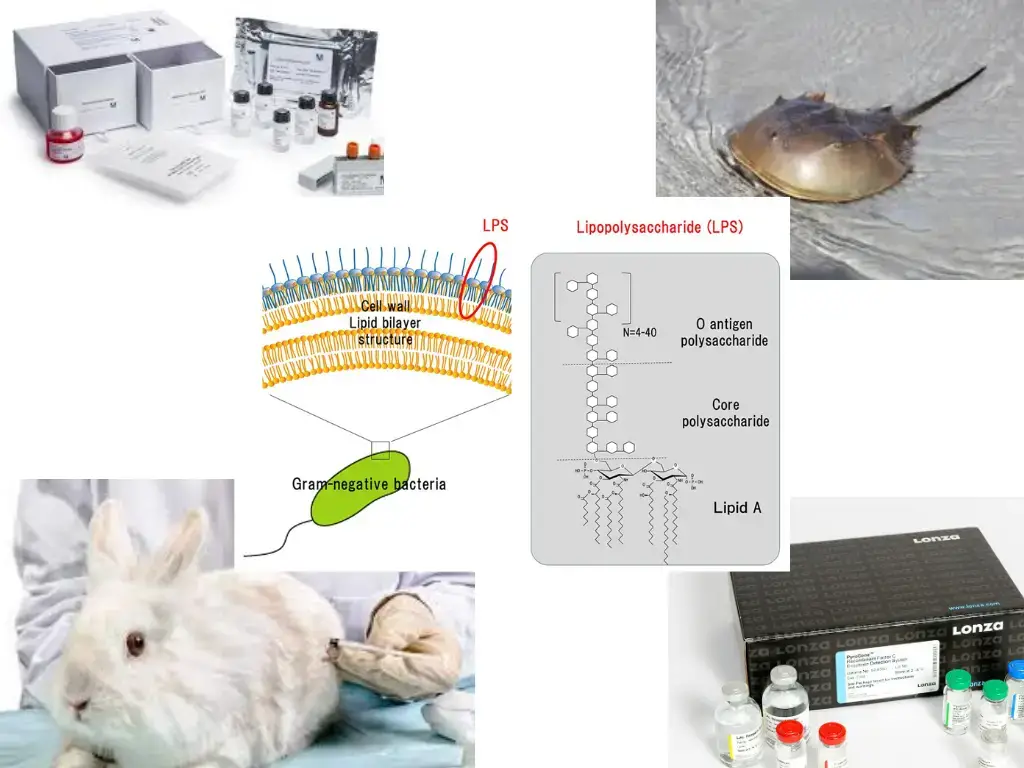
细菌内毒素是在革兰氏阴性细菌细胞壁中发现的脂多糖(LPS)。内毒素被引入血液或脑脊液(脑脊液)时引起发烧,因此也称为热原。
在释放无菌产品之前,细菌内毒素检测是必不可少的,特别是在制药工业中。细菌内毒素或热原检测是在释放与心血管、淋巴系统或脑脊液相关的药物和医疗器械等医疗效果之前对内毒素进行的体外检测。
细菌内毒素检查的重要性
革兰氏阴性细菌是普遍存在的,细菌产生的内毒素可以诱导发烧作为炎症反应。内毒素可以从医疗器械、注射药物、水或与患者血液接触的任何物体中获得。这种反应有时是致命的,特别是在免疫功能低下的人群、儿童和老年人中。
热原或细菌内毒素检测是fda批准的测定热原元素如内毒素的方法。这些检测对于降低患者交叉感染的风险至关重要。
热原检测不同于无菌检测,两种检测应同时进行。无菌检测通常检测存活的生物体或孢子由微生物产生的。无菌检查不能检测内毒素,因此有必要进行热原检查。
细菌内毒素和热原检查方法
细菌内毒素和热原的检测方法简单、易行、可行。不同的方法测试细菌内毒素细菌内毒素试验(BET)或鲎变形细胞裂解物(LAL)试验、重组因子C (rFC)试验、单核细胞活化试验(MAT)和兔热原试验(RPT)。
兔热原试验
兔子热原测试是一种更具侵入性的检测样品中热原存在的方法,涉及将样品注射到许多兔子体内。热原物质的存在导致兔子在注射3-6小时后发热。它也被称为假测试。
由于该方法涉及动物实验,因此被单核细胞活化试验(MAT)和鲎试剂阿米巴细胞裂解试验(LAL)所取代。
RPT原理
兔热原测试(RPT)的基础是测量兔在静脉注射待测样品的无菌溶液后温度的上升。如果样品中含有热原,家兔的体温会升高0.6℃。
RPT程序
进行兔子热原测试(RPT)的程序大致分为两个步骤;初步试验和主要试验。
初步的测试
- 选择三只至少两周没有使用的兔子。保养1-3周。
- 测试期间停止食物供应2小时。记录他们的体温。应该在38.5℃左右。
- 90分钟后静脉注射无热原盐水。
- 注射30分钟后检查温度,再继续检查3小时。
- 如果温度上升0.6℃,则拒绝该动物,选择其他动物。在新动物身上重复初步试验。
主要测试
- 首先,将样品与无热原水混合,并在注射前加热至38℃。
- 试验前2小时不给预试兔喂食。
- 记录初始温度(每隔30分钟两次温度的平均值)。两个读数相差>0.2℃的家兔不能用于实验。
- 将制备好的样品以不小于0.5 ml/Kg、不大于10ml /Kg的剂量注射于三只家兔耳缘静脉。
- 记录动物体温,间隔3小时30分钟。
结果解释
我:没有一只兔子的温度升高了0.6℃,即三只兔子的温度升高之和不超过1.4℃。这意味着没有热原。
案例二:2、3只兔温升≥0.6℃或温升总和超过1.4℃。这表明样品中存在热原。
RPT的应用
兔热原测试是fda批准的检测热原的方法,不仅是内毒素,而且是非内毒素。这是一种检测热原的简单方法,通常被制药公司在释放他们的产品之前使用。
细菌内毒素试验或鲎试剂
细菌内毒素检测是一种利用鲎试剂测定内毒素的体外方法。LAL试验是所有国际药典中最广泛使用和推荐的内毒素测定试验。
BET或LAL测定原理
主要试剂为鲎阿米巴细胞裂解液(LAL),是从马蹄蟹(鲎波吕斐摩斯)。LAL试剂中的原酶与之反应脂多糖(LPS),一种革兰氏阴性细菌内毒素,产生活化酶凝固酶。这种凝固酶的激活主要取决于样品中存在的内毒素的浓度。现在,活化的酶(凝固酶)水解凝血蛋白(凝血蛋白)内部的某些键,凝血蛋白也存在于LAL试剂中。一旦水解完成,所产生的凝血蛋白结合并形成凝块。有四种fda批准的方法来确定形成的血栓凝胶凝块,比色计,分光光度法,显色法。
LAL试验的总体反应
酶原→凝固酶;由革兰氏阴性细菌内毒素催化
Coagulogen→凝固素;由活化的凝固酶催化的
LAL测试程序
LAL检测试剂盒中提供的试剂
- 冻干鲎阿米巴细胞裂解液(LAL):裂解液由马蹄蟹循环的阿米巴细胞制备,鲎波吕斐摩斯.按照FDA参考标准内毒素进行标准化。它还包括缓冲的单价和二价阳离子。然后将该试剂冷冻干燥并在真空下密封。需要用LAL试剂水进行重组。试剂的储存需要在2-8°C进行。长时间暴露在37°C以上的强光和温度下可能会导致试剂不溶性和黄色。试剂就不可用了。
- 冻干大肠杆菌内毒素O55:B5(试验对照生物):纯化的内毒素大肠杆菌菌株O55:B5冻干。当按照说明书准备时,每瓶充当标准控制内毒素(CSE)。其效力低于目前的FDA参考标准内毒素(RSE)。适当的RSE/CSE比值和最终的CSE效价在分析证书中提供。小瓶在重建前保存在2-8°C。效力计算如下:
效价(EU/ml)=RSE/CSE (in EU/ng) 9 _ng/瓶÷ 5.0 ml/瓶。
试剂的制备
拉尔准备
- 将1.8 ml LAL试剂水(16瓶或5.2 ml)添加到50个测试瓶中,重建冻干裂解液。通过彻底旋转至少30秒来混合。不要摇晃,因为里面的东西会起泡。
- 重组裂解液在2-8°C下储存长达24小时而不损失灵敏度。同样,重组的裂解物可以在-10°C以下以方便的体积储存长达四周。
控制标准大肠杆菌准备
- 用5ml LAL试剂水重组内毒素瓶。
- 将内毒素混合15分钟。
- 用LAL试剂水将内毒素稀释至1eu /ml浓度。稀释是通过稀释重组内毒素到1/X;这里,X=分析证书上指定的CSE效价(EU/ml)。
- 搅拌60秒后再继续。
- 使用1eu /ml内毒素溶液,制备两倍稀释系列。在进行连续稀释之前,对每一种稀释进行漩涡。
LAL测试步骤
- 每一种检测方法都需要连续两倍稀释CSE,标记裂解物敏感性,稀释的测试样品和LAL试剂。水作为阴性对照。
- 将0.1 ml的标准品、样品或水转移到10x75毫米的反应管中。
- 向每个试管中加入0.1 ml重组裂解物,从空白开始,从最低的内毒素浓度到最高的内毒素浓度。
- 立即将内容物充分混合,并将试管置于37±1°C非循环热水或干热浴中。每次稀释内毒素时都应进行此过程。
- 同样,未知测试样例与CSE并行运行。
- 孵育时间从将每个试管置于37±1°C的浴槽中开始。在60±2分钟内管未受到干扰。
- 孵育完成后,小心取出试管,翻转180°。
结果解释
结果解释基于凝胶形成(凝胶凝块LAL测定),比色分析,光谱分析,或显色试验中颜色的外观。显色LAL法使用一种合成的显色肽底物,该底物可以裂解成凝血酶,从而得到一种显示黄色的产物。
分光光度法分析采用天然底物凝血素裂解成凝血素。然后凝固蛋白开始自我关联增加浊度。浊度与内毒素浓度相关。
凝胶凝块法是最常用的LAL测试方法。
凝胶凝块测定结果如下:
- 正反应=形成牢固的凝胶,暂时保持完整时,管是倒置的。
- 阴性反应=倒置后无固体凝块。但裂解液可能显示浊度或粘度增加。
需要考虑的事项
- 贮存冻干的LAL试剂大肠杆菌O55:B5在2-8℃的适当温度下是必须的。
- 请勿在使用前立即配制内毒素试剂。
- 将重组的内毒素在2-8°C保存四周。
- 根据需要配制1.0 EU/ml稀释剂,不要储存或使用稀释后的内毒素超过一天。
- 重组裂解试剂在-10°C冷冻四周是可能的。使用前请立即解冻冷冻液体裂解液。只冻结和解冻一个。
LAL测试的应用
- LAL测试被广泛应用于制药行业的药品发布前。由于内毒素是制药工业中最常见的热原,LAL试验是一种简单快速的内毒素检测方法,是兔热原试验的合适替代品。
- 它也有助于生产医疗设备的行业。
- LAL测试有助于避免动物测试的地区,因为与其他测试不同的是,该测试的试剂是从返回自然栖息地的螃蟹中提取的。
重组因子C (rFC)测定
当鲎波吕斐摩斯被革兰氏阴性细菌感染会导致致命的血管内凝血在遗传水平上,已知内毒素激活了丝氨酸蛋白酶催化凝血级联,从而导致了鲎血液的gelato。该级联用于LAL试验。因子C是由内毒素结合激活的级联的第一个成分。因子C激活因子b。另一种替代途径是通过葡聚糖结合激活因子G。因子C和G都将促凝酶转变为凝血酶。因子C可选择性识别内毒素并触发蛋白酶级联。因子C已被纯化和克隆,以建立内毒素特异性测定方法。激活的重组因子C作用于检测混合物中的荧光物质,并产生与样品中的内毒素浓度成正比的荧光信号。
rFC测定原理
内毒素结合激活重组因子c。这种活性结合切割合成底物,从而产生一种含氟化合物。该实验在96孔板上进行。荧光测量时间为0,并在37°C±1°C孵育一小时后,使用380/440 nm的激发波长在微孔板上读数。对数净荧光(一小时与时间零点读数之间的差值=∆RFU)与对数内毒素浓度成正比,并在0.005-5.0 EU/ml范围内呈线性关系。样品内毒素的计算是相对于标准曲线的。
rFC测定步骤
- 将所有测试试剂和样品带到室温下。
- 将100 μ l的空白、内毒素标准品和样品添加到微孔板的所需孔中。
- 在稀释过程中,使用相对于可能背景内毒素的浓度对内毒素标准样品进行Spike。
- 在阅读器中37°C±1°C预孵育10分钟。
- 用含氟底物、测定缓冲液和rFC酶液按5:4:1的比例制备工作试剂。
- 小心地将100 μ l工作剂分配到每个孔中。
- 现在,读出荧光。这是零时刻的荧光。
- 将培养皿孵育一小时,然后阅读培养皿。这是一个小时的阅读。
- 纠正一小时读数与时间零点读数与空格之间的差异。
- 用线性回归曲线绘制净∆RFU与内毒素浓度的比值,然后用标准曲线计算内毒素浓度。
rFC法的应用
- 适用于医疗器械、人畜亲本药品、生物制品中细菌内毒素的测定。
- 它是一种较好的细菌内毒素检测方法。
单核细胞活化试验
单核细胞活化试验(MAT)有助于检测和量化物质,激活人类单核细胞释放介质负责发烧反应。MAT是兔热原检测(RPT)的另一种合适替代品。该测试探索了人类发热反应,比RPT提供了关于热原活性的更好信息。该测试不仅可以确定内毒素热源,还可以帮助确定非内毒素热源。
MAT原理
MAT测试检测细胞因子前列腺素如IL(白细胞介素)1-3和肿瘤坏死因子ɑ(TNF-ɑ)由单核细胞激活的热原物质产生。这些白细胞介素然后检测使用ELISA(酶联免疫吸附试验)。
MAT的一般原理
热原+人白细胞→白介素→ELISA检测,单位为IU/ml。
MAT程序
MAT的一般程序包括三个基本步骤;激活单核细胞,培养产生IL-6,并使用软件进行定量分析。
MAT的要求
以下是执行MAT所需的材料和仪器:
- 生物安全柜
- 湿润孵化器
- 水浴
- 旋涡混合器
- 单/多通道可调量移液管适用于5 ~ 1000 μl(电子推荐)
- IL-6 ELISA试剂盒
- 微量滴定板阅读器
- 软件
- 无热原移液头50毫升的flacons
- Eppendorf微离心机2毫升试管或24孔平板
- 96孔微量滴定板
- 聚苯乙烯一次性吸管
- 制备试剂所需的烧瓶、烧杯和液体容器
- 异丙醇(70%)
单核细胞活化试验(MAT)步骤
- 首先在水浴中解冻A培养基(以重建LPS标准)和B培养基(培养基)。
- 为制备100 EU/ml LPS标准品,在可用的解冻LPS标准瓶中加入950 μl培养基。旋转60秒。然后在培养基B中稀释100 EU/ml标准LPS,但不要使用移液器轻轻混合至0.004-0.5 EU/ml。现在,在培养皿中加入至少一份副本。
- 在此步骤中,在培养基B中准备所需的样品稀释剂,并将相同的稀释剂添加到培养板中。
- 该步骤通过使用水浴解冻低温保存的PBMC来制备外周血单核细胞(PBMC)。将1毫升解冻的PBMC缓慢混合到9毫升培养基B中。在含有100 μl样品稀释液和标准LPS滴定液的培养皿中加入100 μl细胞悬液。
- 然后,在37°C的腐殖化培养箱中,在5% CO的存在下培养板219-20个小时。这有助于激活人类单核细胞在热原物质存在时释放细胞因子。
- 孵育后,取170 μl上清液至96孔培养板,分离细胞上清液。
- 预稀释上清液进行IL-6测定。至少测试MAT上清液配制的两种稀释液;一种用于ELISA,另一种用于总结上清液中所有高浓度和低浓度的IL-6。
- 使用软件量化IL-6浓度。
MAT的用途
- MAT是一种适用于制药业家兔热原检测的替代品。因为它更省时,更准确,成本效益高,可以检测内毒素以及非内毒素热原。
- 它可以帮助检测来自医疗设备和水源的热源。
参考文献
- 细菌内毒素检测|查尔斯河.Criver.com。检索于2022年10月16日,从https://www.criver.com/products-services/qc-microbial-solutions/endotoxin-testing?region=3681.
- 细菌内毒素检查.Houshiji.com。(2012).检索于2022年10月16日,从https://www.houshiji.com/Uploads/Download/5a27396519552.pdf.
- 木糖醇/致热源.美国食品和药物管理局。(2014)。检索于2022年10月16日,从https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/inspection-technical-guides/bacterial-endotoxinspyrogens.
- 鲎变形细胞裂解液(LAL) PYROGENTTMPlus.Lonzabio.jp。检索于2022年10月16日,从http://www.lonzabio.jp/products/endotoxin/pdf/00190168_en.pdf.
- 单核细胞活化测试试剂盒手册.Mstechno.co.jp。检索于2022年10月16日,从https://www.mstechno.co.jp/html/protocolFile/ms622eec285d459/MAT-MANUAL-US-2022.pdf.
- 单核细胞活化试验(MAT).Sigmaaldrich.com。检索于2022年10月16日,从https://www.sigmaaldrich.com/deepweb/assets/sigmaaldrich/marketing/global/documents/109/402/pyromat-white-paper-wp1071en-mk.pdf.
- 单核细胞活化试验.Solvias.com。检索于2022年10月16日,从https://www.solvias.com/docs/download/en/000_Brochures_amp_Flyers/Monocyte_Activation_Test.pdf.
- PyroGene™重组因子C.Bionordika.no。检索于2022年10月16日,从https://bionordika.no/application/files/9416/0285/6144/PyroGene_instructions.pdf.